Zusammenfassung: Generell sind Opioide bei starken chronischen Schmerzen die wirksamsten Analgetika. Obwohl – im Gegensatz zu früheren Ansichten – kein Schmerz prinzipiell opioidresistent ist, können bei unzureichender Schmerzlinderung oder bei intolerablen unerwünschten Arzneimittelwirkungen der Opioide zusätzlich schmerzlindernde Medikamente, sog. Koanalgetika oder Adjuvanzien, hilfreich sein. Besonders häufig versagen Opioide bei neuropathischen, ossären und sympathisch unterhaltenen Schmerzen. Dann besteht frühzeitig eine Indikation für Koanalgetika, wobei die adjuvante Wirksamkeit von Antikonvulsiva und trizyklischen Antidepressiva am besten dokumentiert ist. Die Differentialindikation der vielen in Frage kommenden Koanalgetika sollte sich primär an einer eingehenden Schmerzanamnese, besonders an der angegebenen Schmerzqualität, orientieren. Analog zum allgemein anerkannten erweiterten WHO-Stufenschema zur (Tumor)-Schmerztherapie sollte eine Therapie mit Koanalgetika nur dann durch invasive Therapieverfahren erweitert werden, wenn mehrere Analgetikakombinationen und Alternativsubstanzen ausgeschöpft worden sind und dennoch das Therapieergebnis unbefriedigend war.
Opioide, Nicht-Opioid-Analgetika und Koanalgetika: Pharmakologisch existieren drei Kategorien von Analgetika (1):
1. Opioid-Analgetika. Sie sind die am häufigsten und mit der größten Erfahrung verwendeten Analgetika bei chronischen Schmerzen, speziell bei Tumorschmerzen.
2. Nicht-Opioid-Analgetika, u.a. mit den nichtsteroidalen Antiphlogistika und nichtsauren antipyretischen Analgetika (z.B. Paracetamol, Metamizol)
3. Verschiedene Gruppen sog. Koanalgetika. Sie sind als adjuvant schmerzlindernde Medikamente definiert, deren primäre Indikation jedoch nicht die Schmerztherapie ist.
Ein wichtiger Vorteil der Opioide ist die bei korrekter und auch bei langer Anwendung gute subjektive Verträglichkeit bei geringer Organtoxizität. Ob Schmerzen auf die Gabe von Opioiden reagieren, ist individuell nicht vorherzusagen. Deshalb muß ihre Wirksamkeit empirisch herausgefunden werden. Bei fehlender oder unzureichender Schmerzlinderung ist ein Versuch bzw. eine Erweiterung der Therapie mit Nicht-Opioid-Analgetika und/oder Koanalgetika indiziert.
Schmerzarten: Koanalgetika werden nicht nach der Krankheit bzw. dem Syndrom, sondern besser nach dem Mechanismus und der Qualität des Schmerzes ausgewählt (2). Drei Hauptschmerzarten können unterschieden werden:
1. Nach Irritationen oder Traumen von Geweben, die keine Läsionen peripherer und zentraler neuronaler Strukturen gesetzt haben, entstehen somatische (lokalisierbare, helle, ziehende) oder viszerale (diffuse, tiefe, drückende) Nozizeptor-Schmerzen, wie z.B. ossäre Tumorschmerzen oder Schmerzen nach abdominalchirurgischen Eingriffen.
2. Schmerzen, die nach Schädigung neuronaler Strukturen (durch fehlerhafte lmpulstransmission) entstehen, sind die neuropathischen Schmerzen. Sie sprechen oft schlecht auf Opioide an und zwingen daher zu einem differenzierten Einsatz von Koanalgetika. Der neuropathische Schmerz ist entweder kontinuierlich-brennend oder attackenförmig-einschießend, z.B. als Folge einer Kompression von Nerven oder polyneuropathischer Veränderungen. Die dabei häufig vorhandenen Dysästhesien können vom Patienten oft nur schwer beschrieben werden.
3. Beim sympathisch unterhaltenen Schmerz finden sich neben brennenden Ruheschmerzen auch gelegentlich Ödeme und andere Zeichen der sympathischen Dysregulation.
Charakteristika von Koanalgetika: Bei der Therapie mit Koanalgetika müssen ihre inter- und intraindividuell stark unterschiedlichen Wirkungen bedacht werden. Daher ist ein solcher Therapieversuch nur dann als adäquat anzusehen, wenn die einzelnen als Koanalgetika verwendeten Substanzen (s. Tab. 1) in ausreichend hoher Dosierung über einen angemessenen Zeitraum eingesetzt worden sind. Bei den wenigen therapeutischen Alternativen müssen die klinisch und pharmakologisch gut evaluierten Pharmaka im Hinblick auf ihre koanalgetische Wirksamkeit und auf mögliche intolerable unerwünschte Arzneimittelwirkungen (UAW) geduldig getestet werden, bevor eventuell im Einzelfall konstatiert werden muß, daß sie erfolglos sind. Vor bzw. parallel einer Behandlung mit Koanalgetika sind selbstverständlich immer Indikationen für eine Radio-, Chemo- oder komplementäre Therapie sowie physiotherapeutische und psychologische Therapieansätze zu bedenken. Bei intensiver individueller Austestung der Koanalgetika sind invasive, z.B. neurodestruktive oder rückenmarknahe Formen der Schmerztherapie nur selten erforderlich.
Koanalgetika bei somatischen und viszeralen Nozizeptor-Schmerzen: Leider gibt es keine neuen spezifischeren Koanalgetika zur Behandlung somatischer und viszeraler Nozizeptor-Schmerzen. Die Wirksamkeit der schon länger als „Muskelrelaxanzien“ eingeführten Substanzen, wie Tetrazepam oder andere Benzodiazepine, zur adjuvanten Therapie chronischer Schmerzen muß aufgrund der bis heute mangelhaften Daten eher kritisch gesehen werden. Nach einer neueren Metaanalyse ist mangels intrinsischer analgetischer Potenz auch der Einsatz von Neuroleptika nicht gerechtfertigt (3).
Bei ossären Schmerzen sind die neueren Bisphosphonate von großem Interesse. Bisphosphonate sind Analoga der natürlichen Pyrophosphate (s.a. Übersicht AMB 1998, 32, 41 und 49). Sie binden an Kalziumphosphat-Kristalle und hemmen aufgrund der ihnen eigenen Resistenz gegen hydrolytische Spaltung die Knochenresorption. Durch den festen Einbau in die mineralisierte Knochenmatrix verlängert sich ihre eigentlich kurze Eliminations-Halbwertzeit auf ein Vielfaches entsprechend der jeweiligen Umbaurate des Skeletts. Die Inzidenz osteolytisch bedingter Hyperkalziämien (4) und pathologischer Frakturen (nicht bei allen Tumoren) nimmt ebenso wie der Analgetikabedarf ab. Die Analgesie wird wahrscheinlich durch Hemmung der Osteoblasten und Osteoklasten vermittelt. Pamidronsäure (Aredia), ein Bisphosphonat der zweiten Generation, das länger als Clodronsäure (Bonefos, Ostac) wirkt, scheint auch eine intensivere und dosisabhängige analgetische Wirkung zu haben. In größeren, plazebokontrollierten Studien (5-8), sowie in einer Literaturanalyse (9) wurde bei Patient(inn)en mit Mamma-Karzinom oder mit Plasmozytom eine signifikante Abnahme der Schmerzen gefunden (s. AMB 1996, 30, 52 und 1997, 31, 22b). Die analgetische Wirkung bei Tumoren der Lunge, der Prostata und des Gastrointestinaltrakts ist weniger gut belegt (10). Wegen gelegentlicher gastrointestinaler Unverträglichkeit (11) und der sehr geringen oralen Bioverfügbarkeit (nur 0,3%) wird die i.v. Applikation bevorzugt. Manche Patienten berichten über passagere grippeähnliche Symptome als UAW.
Calcitonin ist ein Polypeptid aus der Nebenschilddrüse, das an der Regulation des Kalziummetabolismus beteiligt ist und eine schnelle und kurze Hemmung der Osteoklasten bewirkt. Zusätzlich wird ein zentral-analgetischer Effekt diskutiert, denn Calcitonin fungiert im ZNS als Neurotransmitter durch Aktivierung serotoninerger absteigender Hemmsysteme und durch Interaktion mit Beta-Endorphin-Opioid-Rezeptoren. Die letztgenannten Effekte korrelieren nicht mit dem Grad der Osteoklastenhemmung und sind auch nicht unter Naloxon reversibel (12). In der neueren Literatur wird Calcitoninen zusammenfassend nur ein mäßiger analgetischer Effekt bescheinigt (13). Zur Indikation Phantomschmerz ist keine neuere Arbeit publiziert worden (14). Die UAW von Calcitonin (z.B. allergische Reaktionen, Übelkeit, Erbrechen, Durchfall) nehmen bei längerer Behandlung zu, während die analgetische Wirkung nachläßt.
Radioisotope werden aufgrund der möglichen Knochenmarkdepression nur sehr zurückhaltend in der Schmerztherapie eingesetzt. Ihre analgetische Wirkung ist Folge einer direkten DNS-Schädigung in den Tumorzellen und ist indirekt auf eine durch Lymphozytenschädigung bedingte Abnahme der Zytokinsekretion zurückzuführen. Radioisotope werden relativ selektiv in Knochenmetastasen aufgenommen; sie kommen daher bei multiplem Skelettbefall in Betracht. Da die analgetische Wirkung verzögert eintritt (manchmal nehmen die Schmerzen initial sogar zu), ist ihr Einsatz sinnvoll, wenn eine Lebenserwartung von mindestens einigen Wochen und ein Karnofsky-lndex > 50 besteht (15). Die Differentialindikationen und Dosierungen der einzelnen Radioisotope sind bislang schlecht definiert (16). Der Beta-Strahler Samarium-153, der zudem eine schwache Gamma-Strahlung emittiert, hat mit 2,2 Tagen eine vergleichsweise kurze Knochenhalbwertzeit. Die analgetische Wirkung ist etwas kürzer und wahrscheinlich geringer als bei Strontium-89 (17). In einer neueren, doppeltblinden und plazebokontrollierten Studie waren schon nach einer Woche ein Drittel der Patienten vollständig und die restlichen zumindest partiell schmerzfrei (18).
Koanalgetika bei kontinuierlich-neuropathischen Schmerzen: Trizyklische Antidepressiva (TZA) sind die erste Wahl bei dieser Schmerzqualität (s. Tab. 2). Sie erhöhen durch Hemmung der Wiederaufnahme die Konzentration der inhibitorischen Transmitter Serotonin und Noradrenalin im synaptischen Spalt absteigender Rückenmarkbahnen. Die analgetische Wirkung ist unabhängig vom antidepressiven Effekt dieser Substanzklasse und tritt bereits nach wenigen Tagen ein. Ältere Arbeiten konnten für die „gemischten“ Wiederaufnahme-Hemmer Amitriptylin (Saroten u.v.a.), Imipramin (Tofranil u.a.) und Clomipramin (Anafranil u.a.) günstige Effekte belegen, die im Vergleich mit anderen Koanalgetika bei vielen Schmerzsyndromen deutlich ausgeprägter waren. Allerdings limitieren besonders die cholinergen UAW die Dosis und die Anwendungszeit. Bei den neueren, hinsichtlich der Hemmung der Serotonin-Wiederaufnahme selektiven Antidepressiva wurde (bei zwar besserer subjektiver Verträglichkeit) bislang keine spezifische analgetische Wirksamkeit gefunden. Ältere positive Arbeiten (19, 20) konnten in einer Metaanalyse nicht bestätigt werden (21). Interessant sind dagegen neuere tierexperimentelle Befunde zur lokalen transdermalen Applikation: Amitriptylin und der selektive Noradrenalin-Wiederaufnahme-Hemmer Desipramin (Pertofran, Petylyl) waren bei inflammatorischen und neuropathischen Schmerzen wirksam und verursachten gegenüber der oralen Applikation deutlich weniger UAW (22).
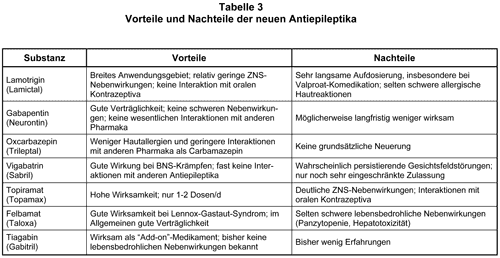
Pharmaka der zweiten Wahl für den kontinuierlichen neuropathischen Schmerz sind die Antikonvulsiva, wobei bislang meist Carbamazepin (Tegretal u.v.a.) eingesetzt wurde. Gabapentin (Neurontin) ist ein neueres Antikonvulsivum mit einem einzigartigen Wirkprinzip an den spannungskontrollierten Kalziumkanälen und einem günstigen Nebenwirkungsprofil (s.a. AMB 2001, 35, 1). Zwei Studien aus dem Jahre 1998 (23, 24) waren Anlaß für die Einführung von Gabapentin in die Schmerztherapie (25, 26). Neben der Schmerzreduktion ist als positive Wirkung von Gabapentin auch über eine Besserung von Stimmung, Schlaf und allgemeiner „Lebensqualität“ berichtet worden. In einer neueren Studie war eine moderate Dosis Gabapentin (900-1800 mg/d) bei schmerzhafter diabetischer Polyneuropathie ebenso wirksam wie Amitriptylin (25-75 mg/d; 27). Klinisch wichtig ist die Beobachtung, daß Gabapentin als „Add-on-Medikation“ bei unzureichender Analgesie bzw. intolerablen UAW unter Opioiden bei neuropathischen Tumorschmerzen wirksam ist, besonders wenn eine Allodynie besteht, d.h. Schmerzsensationen schon bei nichtnoxischer Reizung (leichte Berührung oder Druck, üblicherweise nicht als schmerzhaft empfundene Wärme oder Kälte). Diese besondere Wirksamkeit bei Allodynie ist auch in Tiermodellen dosisabhängig bestätigt worden (28, 29). Die zur Zeit noch hohen Therapiekosten rechtfertigen keinen universellen Einsatz von Gabapentin; sie sollten jedoch bei therapieresistenten Schmerzen nicht im Wege stehen.
Eine weitere Therapieoption bei kontinuierlich-neuropathischem Schmerz ist das topisch zu applizierende Capsaicin (in Capsamol enthalten), ein Extrakt aus Capsicum annum (Cayenne-Pfeffer). Es stimuliert peripher am terminalen Nozizeptor und zentral die Freisetzung von Substanz P und anderen Neurotransmittern und führt – nach initialer Zunahme des Schmerzes – zu einer Funktionseinschränkung (Desensibilisierung) der peripheren terminalen Schmerzbahn (30). Neuere klinische Studien kamen allerdings zu widersprüchlichen Ergebnissen (31-35). Die Empfehlung beschränkt sich daher auf die Behandlung der Postzoster-Neuralgie, insbesondere wenn ein Allodynie-Areal besteht.
Koanalgetika bei attackenförmig-neuropathischen Schmerzen: Antikonvulsiva reduzieren die Übererregbarkeit und die paroxysmalen elektrischen Entladungen traumatisierter peripherer und zentraler Neurone. Hauptindikation sind daher einschießende, stechende und elektrische Schmerzqualitäten. Eine weitere Indikation sind therapierefraktäre Brenn-Dysästhesien. Therapeutikum der ersten Wahl ist Carbamazepin (s. Tab. 2). Seine zentralen UAW unterliegen zwar häufig einer Toleranz; trotzdem ist die Einstellung mit Carbamazepin oft unbefriedigend. Gabapentin kann hier als Koanalgetikum der zweiten Wahl eingesetzt werden.
Lamotrigin (Lamictal) inhibiert die Freisetzung exzitatorischer Aminosäuren durch präsynaptische Blockade von Natriumkanälen. In einer kürzlich erschienenen randomisierten, doppeltblinden, plazebokontrollierten Studie (36) wurden Patienten mit unterschiedlichen neuropathischen Schmerzsyndromen untersucht. Lamotrigin hatte in einer Dosis von bis zu 200 mg/d keinen analgetischen Effekt.
Phenytoin (Epanutin, Phenhydan) ist ein älteres Antikonvulsivum mit guter analgetischer Wirksamkeit bei neuropathischen Schmerzen (37, 38). Von besonderem Interesse ist eine neuere Untersuchung, in der Phenytoin als Infusion (15 mg/kg in 2 h) zur akuten Behandlung neuropathischer Schmerzspitzen eingesetzt wurde (39). Die Schmerzlinderung war schnell und hielt mehrere Tage an. Diese Therapie könnte in der klinischen Praxis als akute Intervention im Rahmen einer längerfristigen Einstellung genutzt werden, um Zeit zu gewinnen.
Bei unzureichender Analgesie mit Antikonvulsiva sind Natriumkanalblocker eine weitere Option. Das Klasse IB-Antiarrhythmikum Mexiletin (Mexitil) ist wegen seiner im Vergleich mit anderen Antiarrhythmika deutlich geringeren kardiotoxischen Wirkung der einzige orale Vertreter dieser Klasse. Die systemische Applikation führt nicht wie bei der Lokalanästhesie zu einem Konduktionsblock, sondern scheint aberrante elektrische Aktivitäten von Hinterhorn-Neuronen bei verschiedenen neuropathischen Schmerzsyndromen zu supprimieren (40-42). UAW sind häufig und dosisabhängig. Mexiletin scheint bei kardial gesunden Tumorpatienten mit attackenförmigem neuropathischem Schmerz, wie z.B. bei lumbosakraler Plexopathie, geeignet zu sein (43). Größere Studien fehlen allerdings noch.
Analgetische Effekte treten auch nach Kurzinfusion von Lidocain auf (44, 45). In einer neueren Untersuchung wurde die Wirksamkeit von topisch als Pflaster appliziertem Lidocain bei der Postzoster-Neuralgie untersucht (46). Ohne daß systemische Wirkungen auftraten, konnten diese Schmerzen anhaltend und signifikant gelindert werden.
Der sympathisch unterhaltene Schmerz ist eine Domäne der selektiven Blockade des sympathischen Grenzstrangs und der speziellen Physiotherapie. In der Pharmakotherapie ist als Koanalgetikum neben den etablierten, wenn auch wenig überzeugenden Pharmaka Clonidin, Phentolamin und Guanethidin der periphere Alpha1-Adrenorezeptor-Blocker Phenoxybenzamin (Dibenzyran) zu erwähnen. Das neuerliche Interesse wurde durch eine vielversprechende Publikation geweckt (47).
Multimodal wirkende Koanalgetika: Zu den multimodal wirkenden Koanalgetika gehören die Glukokortikoide. Sie scheinen aufgrund ihrer speziellen Pharmakodynamik für die Behandlung ossärer Schmerzen besonders gut geeignet zu sein, wenn auch nur eine unkontrollierte Studie dies zeigen konnte (48). Die Hemmung der Synthese von Zytokinen könnte einen lokalen antihyperalgetischen Effekt im Knochen haben. Bei neuropathischen Schmerzen, z.B. bei akuter spinaler Stenosierung, vielleicht auch bei tumoröser Infiltration eines Nervenplexus, scheint die Steroidwirkung dosisabhängig zu sein (49).
N-Methyl-D-Aspartat-(NMDA)-Antagonisten werden zur Zeit stark beforscht (Übersicht bei 50). Ketamin (Ketanest u.a.) ist aufgrund seiner analgetischen und dissoziativen Potenz ein häufig verwendetes Anästhetikum für kleinere chirurgische Eingriffe. Seine Anwendung bei chronischen Schmerzen wird jedoch von psychomimetischen UAW limitiert. Ketamin bindet nichtkompetitiv an die NMDA-Rezeptoren, die eine zentrale Rolle bei der spinalen Neuroplastizität spielen, indem sie exzitatorische Aminosäuren, wie Glutamat, inhibieren. Die orale Applikation von Ketamin ist als noch experimentell anzusehen. Wegen der günstigen Wirkung bei Hyperalgesie und Allodynie bei einigen Patienten mit verschiedenen neuropathischen Schmerzsyndromen (51, 52) ist der probatorische Einsatz bei therapieresistenten Dauerschmerzen jedoch zu rechtfertigen. Die prophylaktische (z.B. präoperative) Wirksamkeit von NMDA-Antagonisten wird weiterhin kontrovers diskutiert (53). Andere NMDA-Antagonisten, wie Amantadin (PK-Merz u.v.a.) und Memantin (Akatinol), sind derzeit noch nicht zu beurteilen. Allerdings kommt eine Metaanalyse zu dem Ergebnis, daß mit Dextromethorphan bei diabetischer Polyneuropathie mit einer „Number-needed-to-treat“ von 1,9 eine 50%ige Schmerzreduktion zu erwarten ist (21). Interessant ist die Beobachtung, daß die additive Gabe von NMDA-Antagonisten zu Opioiden das Entstehen einer Opioid-Toleranz verhindern und eventuell eine bestehende Opioid-Toleranz auch durchbrechen kann (54).
Experimentelle Koanalgetika: Experimentelle Untersuchungen haben gezeigt, daß Adenosin (Adrekar) am antinozizeptiven Adenosin-A1-Rezeptor möglicherweise schmerzmodulierend wirkt. In zwei kleineren Fallserien (55, 56) konnte nach intrathekaler bzw. systemischer Applikation ein antihyperalgetischer Effekt nachgewiesen werden. Eine Therapieempfehlung läßt sich davon nicht ableiten. Ähnliches gilt für den Muskelrelaxans-Antagonisten Neostigmin (57). Cannabis und Cannabinoide haben sich bisher in der Schmerztherapie bei Tumoren wegen nur geringer Wirkung nicht durchgesetzt (58; s.a. AMB 2001, 35, 77a). Magnesium wurde aufgrund seiner angenommenen antagonistischen Wirkung am NMDA-Rezeptor kürzlich getestet (59). Die analgetische Wirkung war jedoch kurz und von fraglicher klinischer Relevanz.
Andere potentielle Koanalgetika sind Neuropeptid FF, ein Oktapeptid mit spezifischen spinalen Rezeptoren (60), Gamma-Amino-Buttersäure (61) und neuere Kalziumkanal-Blocker (62). Sie sind bislang nur im Tierversuch getestet worden und klinisch daher noch nicht zu beurteilen.
Bewertung und Ausblick: Die Entwicklung und Untersuchung neuerer Koanalgetika hat das Verständnis für die komplexe Pathophysiologie chronischer Schmerzen deutlich vorangebracht, ohne jedoch die klinischen Anwendungen neuerer Koanalgetika zu befördern (38). Allein die Wirksamkeit von TZA bei Postzoster-Neuralgie bzw. Polyneuropathie ist mit qualitativ ausreichenden Studien nachgewiesen. Auch die neueren Bisphosphonate (z.B. Pamidronsäure) bei ossären Tumorschmerzen und das neue Antikonvulsivum Gabapentin bei neuropathischen Schmerzen können als Koanalgetika empfohlen werden. Tierexperimentelle und die bisher wenigen klinischen Studien lassen weitere Untersuchungen zur topischen, nebenwirkungsarmen Applikation von Lidocain sowie zur individuellen probatorischen Anwendung von NMDA-Antagonisten als lohnend erscheinen.
Literatur
1. Portenoy, R.K.: J. Pain Symptom Manag. 2000, 19 (Suppl. 1), S16.
2. Baron, R.: Anaesthesist 2000, 49, 373.
3. Nix, W.A.: Der Schmerz 1998, 12, 30.
4. Kovacs, C.S., et al.: J. Pain Symptom Manag. 1995, 10, 224.
5. Berenson, J.R., et al.: J. Clin. Oncol. 1998, 16, 593.
6. Berenson, J.R., et al.: N. Engl. J. Med. 1996, 334, 488.
7. Hortobagyi, G.N., et al.: N. Engl. J. Med. 1996, 335, 1785.
8. Thürlimann, B., et al.: Support Care Cancer 1994, 2, 61.
9. Fulfaro, F., et al.: Pain 1998, 78, 157.
10. Clarke, N.W., et al.: Brit. J. Cancer 1991, 63, 420.
11. Coleman, R.E., et al.: Eur. J. Cancer 1998, 34, 820.
12. Ormazabal, M.J., et al.: Eur. J. Pharmacol. 1997, 340, 81.
13. Kreeger, L.: Pain Symptom Manag. 1999, 17, 2.
14. Jaeger, H. und Maier, C.: Pain 1992, 48, 21.
15. Schmeler, K., und Bastin, K.: Hosp. J. 1996, 11, 1.
16. Hoskin, P.J.: Clin. Orthop. Rel. Res. 1995, 312, 105.
17. Scher, H.l. und Chung, W.K.: Semin. Oncol. 1994, 21, 630.
18. Serafini, A.N., et al.: J. Clin. Oncol. 1998, 16, 1574.
19. Sindrup, S.H., et al.: Clin. Pharmacol. Ther. 1992, 52, 547.
20. Sindrup, S.H., et al.: Pain 1990, 42, 135.
21. Sindrup, S.H., und Jensen, T.S.: Pain 1999, 83, 389.
22. Sawynok, J., et al.: Pain 1999, 82, 149.
23. Rowbotham, M., et al.: JAMA 1998, 280,1837.
24. Backonja, M., et al.: JAMA 1998, 280, 1831.
25. Magnus, L.: Epilepsia 1999, 40 (Suppl. 6), S66.
26. Beydoun, A.: Epilepsia 1999, 40 (Suppl. 6), S51.
27. MoreIlo, C.M., et al.: Arch. Intern. Med. 1999, 159, 1931.
28. Chen, S.R., et al.: Anesthesiology 2000, 92, 500.
29. Hao, J.W., et al.: Neurosci. Lett. 2000, 280, 211.
30. Fusco, B.M., und Giacovazzo, M.: Drugs 1997, 53, 909.
31. Epstein, J.B., und Marcoe, J.H.: Oral Surg. Oral Med. Oral Pathol. 1994, 77, 135.
32. Biesbroeck, R., et al.: Adv. Ther. 1995, 12, 111.
33. Ellison, N., et al.: J. Clin. Oncol. 1997, 15, 2974.
34. Padilla, M., et al.: J. Am. Dent. Assoc. 2000, 131, 184.
35. Paice, J.A., et al.: J. Pain Symptom Manag. 2000, 19, 45.
36. McCleane, G.: Pain 1999, 83,105.
37. McQuay, H. et al.: Br. Med. J. 1995, 311, 1047.
38. Kingery, W.S.: Pain 1997, 73,123.
39. McCleane, G.: Anesth. Analg. 1999, 89, 985.
40. Kalso, E., et al.: Eur. J. Pain 1998, 2, 3.
41. Chabal, C., et al.: Anesthesiology 1992, 76, 513.
42. Awerbuch, G.l., und Sandyk, R.: Int. J. Neurosci. 1990, 55, 129.
43. Sloan, P., et al.: Anesth. Analg. 1999, 89, 760.
44. Wallace, M.S., et al.: Pain 1996, 66, 69.
45. Attal, N., et al.: Neurology 2000, 54, 564.
46. Galer, B.S., et al.: Pain1999, 80, 533.
47. Malik, V.K., et al.: Anesthesiology 1998, 88, 823.
48. Tannock, I., et al.: J. Clin. Oncol. 1989, 7, 590.
49. Kramer, J.A.: Palliat. Med. 1992, 6, 202.
50. Sang, C.N.: J. Pain Symptom Manag. 2000, 19 (Suppl.), S21.
51. Enarson, M.C., et al.: J. Pain Symptom Manag. 1999, 17, 384.
52. Haines, D.R., und Gaines, S.P.: Pain 1999, 83, 283.
53. Adam, F., et al.: Anesth. Analg. 1999, 89, 444.
54. Allen, R.M., und Dykstra, L.A.: Psychopharmacology 2000, 148, 59.
55. Belfrage, M., et al.: Anesth. Analg. 1999, 89, 136.
56. Sjolund, K.F., et al.: Anesth. Analg. 1999, 88, 605.
57. Lauretti, G.R., et al.: J. Clin. Anesth. 1999, 11, 663.
58. Sharpe, P., und Smith, G.: Anesth. Analg. 2000, 90, 237.
59. Crosby, V., et al.: J. Pain Symptom Manag. 2000, 19, 35.
60. Courteix, C., et al.: Br. J. Pharmacol. 1999, 127, 1454.
61. Eaton, M.J., et al.: Brain Res. 1999, 835, 334.
62. Vanegas, H., und Schaible, H.-G.: Pain 2000, 85, 9.