Zusammenfassung: Obwohl inzwischen fünf, teilweise miteinander konkurrierende Tyrosinkinase-Inhibitoren zur Behandlung der chronisch myeloischen Leukämie (CML) verfügbar sind, werden von den pharmazeutischen Unternehmen sehr hohe – besonders in den USA steigende – Preise für diese Wirkstoffe verlangt. In der Wirtschaft bezeichnet man ein derartiges Verhalten als „kollektives Monopol”. Für die Behandlung der CML, aber natürlich auch für andere Krebserkrankungen sollten sich die Preise am erzielten Nutzen für die Patienten orientieren. Es muss unbedingt verhindert werden, dass durch Profitmaximierung pharmazeutischer Unternehmen individuellen Patienten und der Gesellschaft insgesamt Schaden zugefügt wird.
Die hohen Preise onkologischer Arzneimittel sind in den letzten Jahren häufig kritisch kommentiert worden – insbesondere, da die Therapieergebnisse mit den neuen, angeblich zielgerichteten Wirkstoffen häufig enttäuschend sind (1, 2). So kostet beispielsweise die Behandlung mit dem monoklonalen Antikörper Cetuximab (Erbitux®) über 18 Wochen etwa 80.000 US-$, obwohl sie das Überleben bei Patienten mit fortgeschrittenem, nicht-kleinzelligem Bronchialkarzinom nur um 1,2 Monate verlängert (1). Therapeutische Fortschritte, wie sie in der Behandlung der Philadelphia-Chromosom-positiven (Ph+) chronischen myeloischen Leukämie (CML) mit dem Tyrosinkinase-Inhibitor (TKI) Imatinib (Glivec®) erzielt werden, waren und sind leider die Ausnahme (3).
Etwa 120 Experten in der Erforschung und Behandlung der CML haben jetzt die aus ihrer Sicht nicht mehr vertretbaren, astronomischen Preise der bei CML eingesetzten TKI scharf kritisiert. In ihrem am 25. April 2013 online in der Zeitschrift „Blood” veröffentlichten Artikel (4) diskutieren sie auch die von pharmazeutischen Unternehmern (pU) immer wieder als Begründung angeführten Forschungs- und Entwicklungskosten für neue onkologische Wirkstoffe – angeblich 1 Mrd. € (5). Diese Preispolitik sei unseriös und habe negative Konsequenzen für Patienten mit CML. Unter den Autoren dieses wichtigen couragierten Artikels befindet sich Brian Druker, der vor etwa 25 Jahren Nicholas Lydon, einen Wissenschaftler bei Ciba-Geigy (seit 1996 Novartis), aufmerksam machte auf die Bedeutung der CML als Modellerkrankung für die Testung zielgerichteter Wirkstoffe (6, 7). Der damals bereits von Ciba-Geigy patentierte TKI STI571 wurde ihm daraufhin vom pU für präklinische Untersuchungen und auch frühe Phasen der klinischen Forschung zur Verfügung gestellt. Die von der Arbeitsgruppe um Brian Druker vorgelegten Ergebnisse ihrer akademischen Forschung überzeugten letztlich auch Novartis und führten dazu, dass STI571 seit 1995 als „lead compound” in der klinischen Forschung untersucht und 2001 als Imatinib zur Behandlung der CML zugelassen wurde (3). Der pU war zunächst skeptisch diesen TKI zu entwickeln wegen der Seltenheit der CML und dem deshalb als wenig lukrativ erscheinenden Markt. Die Jahrestherapiekosten von Imatinib betrugen 2001 in den USA etwa 30.000 US-$ und liegen heute bei 92.000 US-$ (4). Seit seiner Zulassung hat sich Imatinib, das ursprünglich ein „Orphan Drug” für eine seltene Erkrankung (jährliche Inzidenz der CML 1-2/100.000 Einwohner) war, rasch von einem „Orphan Nichebuster” zu einem „Blockbuster” entwickelt. Imatinib erzielte im Jahr 2012 weltweit einen Umsatz von 4,7 Mrd. US-$ und dies, weil der Wirkstoff neben der Behandlung der CML heute für fünf weitere Indikationen zugelassen ist, darunter die Ph+ akute lymphatische Leukämie (ALL) und c-Kit-positive maligne gastrointestinale Stromatumoren (8). Imatinib als Inhibitor verschiedener TK mit onkogenem Potenzial gilt deshalb heute zu Recht als Paradigma für die Entwicklung einer Biomarker-basierten, zielgerichteten Therapiestrategie.
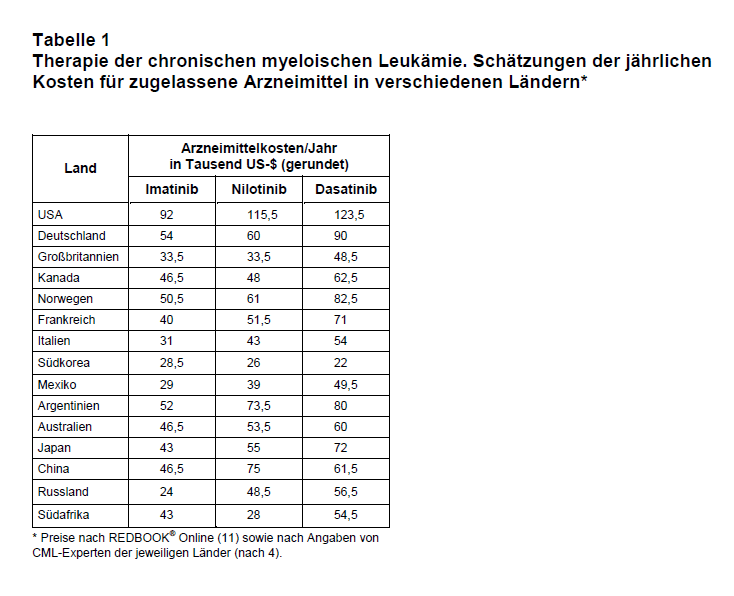
Zwölf Jahre nach Zulassung von Imatinib zur Behandlung der CML, stehen inzwischen, auch aufgrund sehr enger Zusammenarbeit zwischen Wissenschaftlern und pU, in den USA insgesamt fünf TKI und in Deutschland vier TKI zur Behandlung der CML zur Verfügung. Neben Imatinib sind dies: Dasatinib (Sprycel®), Nilotinib (Tasigna®; 9), Bosutinib (Bosulif®) und Ponatinib (Iclusig®; positives Votum der Europäischen Arzneimittel-Agentur vom 21. März 2013, noch keine Zulassung in Deutschland). Im Unterschied zu Imatinib sind diese TKI nur zugelassen zur Behandlung der Ph+ CML (alle TKI; Bosutinib jedoch erst nach Vorbehandlung mit einem anderen TKI) sowie Ph+ ALL (Dasatinib). Die Jahrestherapiekosten der beiden erst 2012 in den USA zugelassenen TKI, Bosutinib und Ponatinib, betragen 118.000 US-$ bzw. 138.000 US-$ (4). Die Dauer der Nachbeobachtung in klinischen Studien für neue TKI ist noch kurz und deren Wirksamkeit (z.B. Überlebensrate im Vergleich zu Imatinib) sowie langfristige Sicherheit kann nicht endgültig beurteilt werden (9). Die Jahrestherapiekosten von Imatinib, Nilotinib und Dasatinib in unterschiedlichen Ländern und Kontinenten sind in Tab. 1 dargestellt (4). Die Zahlen verdeutlichen, dass die Arzneimittelkosten stark variieren, in den USA aber fast immer doppelt so hoch sind wie in den anderen Ländern.
Wie erklären sich diese Preisunterschiede und die sehr hohen Kosten für diese TKI? Die Autoren des Artikels in Blood widmen sich ausführlich dieser Frage. Der ursprünglich für Imatinib in den USA von Novartis verlangte Preis (30.000 US-$) orientierte sich an den Entwicklungskosten, der erwarteten Verlängerung des Patientenüberlebens und vor allem am Preis von Interferon-alfa, dem 2001 als Standardmedikament zur Behandlung der CML eingesetzten Zytokin (3). Ausgehend von einer Prävalenz von etwa 30.000 Patienten mit CML in den USA sowie einer raschen und fast vollständigen „Marktpenetration”, erwartete der pU jährliche Einnahmen allein in den USA von etwa 900 Mio. US-$. Die Kosten für Forschung und Entwicklung von Imatinib hätte Novartis somit innerhalb von weniger als zwei Jahren wieder hereinbekommen. Imatinib und später auch Dasatinib und Nilotinib entwickelten sich, was damals sicher noch nicht abzusehen war, zu den mit Abstand erfolgreichsten Vertretern unter den „zielgerichteten” onkologischen Wirkstoffen. Sie bewirkten, dass die jährliche Sterblichkeit an CML von 10–20% auf 2% sank und mehr als 80% der Patienten mit CML zehn Jahre später noch leben (4). Diese eindrucksvolle Verbesserung der Prognose hat dazu geführt, dass sich in führenden Arzneimittelmärkten (z.B. USA, Japan, Deutschland) die Zahl der für eine Therapie mit Imatinib oder den neueren TKI in Frage kommenden Patienten mit Ph+ CML mehr als verdoppelt hat.
Die Prävalenz von CML weltweit beträgt heute etwa 1,2-1,5 Mio. Patienten (4). Basierend auf den Verkaufszahlen ist davon auszugehen, dass nur etwa 235.000-250.000 Patienten und somit weniger als 20-25% derzeit mit Imatinib behandelt werden (4). Dies bedeutet, dass vor allem infolge der hohen Preise viel zu wenige Patienten mit CML das heute als medizinischer Standard geltende Arzneimittel erhalten und wahrscheinlich früher an dieser Krankheit sterben. Auch in Industrienationen wie den USA nehmen wegen der hohen Kosten etwa 10% der Patienten mit CML keine TKI ein. Dies hat zur Folge, dass im Unterschied zu Ländern mit sehr guter Therapieadhärenz (z.B. Schweden) die Überlebensrate nach fünf Jahren nur 60% beträgt (4). Stark überhöhte, nicht gerechtfertigte Preise bewirken, dass sich viele Patienten in Gesundheitssystemen wie in den USA – dort zahlen Patienten durchschnittlich 20% der Arzneimittelkosten aus eigener Tasche – lebenserhaltende Medikamente nicht leisten können. Vor diesem Hintergrund sind die enormen, in erster Linie durch Profitstreben der pU verursachten Preissteigerungen bei den TKI, vor allem in den USA, inakzeptabel. Wie sehr Wettbewerb auf nationaler Ebene und letztlich auch gesundheitspolitische Entscheidungen die Preise für TKI beeinflussen können, zeigt das Beispiel Südkorea. Dort wurde von den Zulassungsbehörden mit Radotinib ein in Südkorea entdeckter und entwickelter TKI (Jahrestherapiekosten 21.500 US-$) zugelassen. Die jährlichen Kosten für andere TKI wie Imatinib, Dasatinib und Nilotinib betragen in Südkorea nur 21.000-28.000 US-$ (4; s. Tab. 1).
Ein weiterer von den Autoren des Artikels in „Blood” ebenfalls zu Recht kritisierter Aspekt ist die seit langem bekannte Strategie der pU, bei lukrativen Wirkstoffen die Einführung von Generika zu verzögern (4). Das in den USA im Mai 2013 auslaufende Patent für Imatinib wurde vom US-Patentamt bis zum Januar 2015 verlängert. Die Patentlaufzeit von Imatinib ist in den verschiedenen Ländern unterschiedlich. Solche Absprachen zwischen Herstellern von Originalpräparaten und von Generika mit dem Ziel, den Markteintritt von Generika hinauszuschieben, müssen verhindert werden. Durch derartige Praktiken wird sowohl den nationalen Gesundheitssystemen als auch Patienten großer Schaden zugefügt. Der Entscheid des obersten Gerichts Indiens, Novartis kein Patent für Glivec® zu gewähren, ist deshalb aus unserer Sicht sehr zu begrüßen (10). Dieses aktuelle Urteil ist wegweisend für die Gesundheitspolitik in Entwicklungsländern, denn dadurch wird weniger Wohlhabenden der Zugang zu lebensnotwendigen Arzneimitteln zu erschwinglichen Preisen ermöglicht. Dass dies nicht nur in Entwicklungsländern erforderlich ist, zeigt das Beispiel USA.
Literatur
- Fojo, T., undGrady, C.: J. Natl. Cancer Inst. 2009, 101, 1044. Link zur Quelle
- Ludwig,W.-D., et al.: Der Onkologe 2009, 15, 1004.
- AMB 2001, 35,47b Link zur Quelle . AMB 2003, 37, 28. Link zur Quelle
- Kantarjian,H., et al.: Blood 2013; online April 25. Link zur Quelle
- Light, D.W.,und Lexchin, J.R.: BMJ 2012, 345, e4348. Link zur Quelle
- Druker, B.J.:Nat. Med. 2009, 15, 1149. Link zur Quelle
- Johnston,S.C., et al.: Nat. Med. 2011, 17, 434. Link zur Quelle
- AMB 2008, 42,73. Link zur Quelle
- AMB 2008, 42, 01 Link zur Quelle . AMB 2010, 44, 01. Link zur Quelle
- http://www.nzz.ch/aktuell/… verschaerfter-protektionismus-indiens Link zur Quelle
- http://aapredbook.aappublications.org/ Link zur Quelle