Zusammenfassung: Wenige, besonders hochpreisige Arzneimittel belasten die öffentlichen Budgets sehr stark und bringen die europäischen Solidarsysteme in Bedrängnis, selbst in wirtschaftlich starken Ländern. Dabei sind weder die „echten“ Arzneimittelpreise, welche von öffentlichen Kostenträgern in vertraulichen Abkommen mit pharmazeutischen Unternehmen vereinbart werden, noch die Forschungs- und Entwicklungskosten, die häufig als ein Grund für steigende Preise genannt werden, bekannt und nachvollziehbar. Mögliche Lösungsansätze für eine bezahlbare, am Nutzen orientierte Preisbildung sind: mehr Transparenz, Kooperation zwischen Staaten – die von Erfahrungsaustausch über gemeinsame Nutzenbewertung bis zum gemeinsamen Einkauf reichen könnten – sowie eine Neugestaltung der Anreizstrukturen und Rahmenbedingungen für die Arzneimittelforschung, einschließlich Änderungen im Patentrecht.
Nicht erst seit der Zulassung von Sofosbuvir sind hochpreisige Arzneimittel (vgl. 1) ein Thema für maßgebliche Akteurinnen und Akteure im Gesundheitssystem. Politische Entscheidungs- und Kostenträger wollen ihrer Bevölkerung Zugang zu neuen Medikamenten gewähren und zugleich Verantwortung für die Wahrung der finanziellen Nachhaltigkeit der Gesundheitssysteme tragen. Ärztinnen und Ärzte fühlen sich der bestmöglichen Therapie gegenüber ihren Patientinnen und Patienten verpflichtet und Patientinnen und Patienten haben aus verständlichen Gründen selbst ein großes Interesse an neuen Therapien. Auch Medien sind sich des Spannungsfelds zwischen Politik und Gesundheitsdienstleistern bewusst. Bereits zuvor waren die Preise mancher neuer Arzneimittel ein Anlass zur Sorge, insbesondere jene von Onkologika (2-6) und Arzneimitteln für seltene Krankheiten (7).
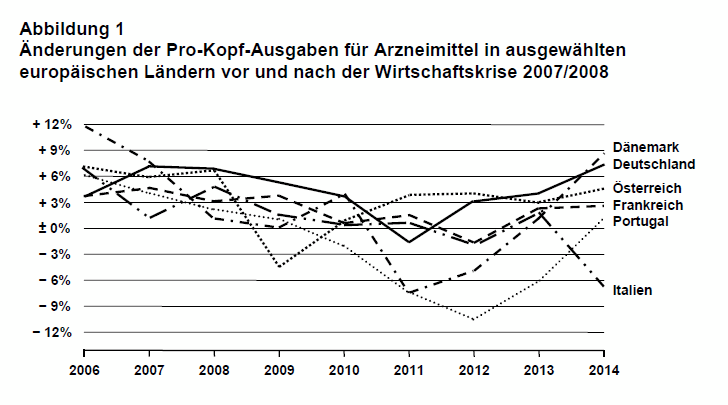
Belastung der öffentlichen Budgets: Die Ausgaben für Arzneimittel sind im letzten Jahrzehnt in allen europäischen Ländern kontinuierlich gestiegen. In Deutschland und Österreich lagen die Steigerungsraten der Pro-Kopf-Arzneimittelausgaben, gemessen in kaufkraftbereinigten US-$, vor der globalen Finanzkrise zwischen 3,5 und 6,7 bzw. 6,1 und 7,7%. Während der Wirtschaftskrise stiegen sie deutlich weniger, und sie waren 2009 in Österreich und 2011 in Deutschland sogar rückläufig. Seit 2012 ist abermals ein Anstieg der Ausgaben zu beobachten, der in Deutschland 2014 bereits wieder das Niveau der Zeit vor 2007/2008 erreicht hat. In einigen europäischen Ländern, vor allem in Mittel- und Osteuropa, waren Steigerungsraten vor und nach der Krise im zweistelligen Bereich keine Seltenheit (8). Ein solcher Anstieg kann durchaus ein Indiz für einen verbesserten Zugang zu Arzneimitteln sein, weil im Sinne der „Universal Health Coverage“ (am ehesten zu übersetzen mit „allgemeine Gesundheitsversorgung“), eines strategischen Entwicklungsziels der Weltgesundheitsorganisation, Länder das Angebot an öffentlich (ko)finanzierten Medikamenten ausweiten bzw. weitere Bevölkerungsgruppen einbeziehen (9). Dies ist insbesondere in jenen Ländern der Fall, die von einem niedrigen Niveau der Arzneimittelversorgung aus starten. Steigende Ausgaben für Arzneimittel können aber auch dadurch bedingt sein, dass Preise oder die Zahl der Verordnungen überproportional zugenommen haben. Jährliche Steigerungen der öffentlichen Arzneimittelausgaben geben darüber Aufschluss (vgl. Abb. 1 für ausgewählte Länder). So zeigte sich, dass in den Jahren der globalen Finanzkrise die Arzneimittelausgaben (pro Kopf, kaufkraftgewichtet) stagnierten und in „Krisenländern“ rückläufig waren. Anlass zur Sorge gibt insbesondere eine Verschiebung der Ausgaben von den öffentlichen Kostenträgern zu den privaten Haushalten, die in einzelnen Ländern zu beobachten war, z.B. Anteil privater Arzneimittelausgaben 2010 bzw. 2014 in Griechenland: 20,7% bzw. 43,6%; Portugal: 36,9% bzw. 45,4%; Spanien 24,5% bzw. 38,7% (8).
In den letzten Jahren stiegen die Ausgaben für Arzneimittel jedoch ungewöhnlich stark. Analysen deuten darauf hin, dass die Steigerungen im Wesentlichen durch die Preise induziert sind, denn in den vergangenen Jahren waren in zunehmendem Maße wenige Arzneispezialitäten für einen hohen Anteil der öffentlichen Ausgaben verantwortlich (10, 11). Dies weist auf außerordentlich hohe Preise einzelner Medikamente hin (in Deutschland als „Mondpreise“ bezeichnet“), die die europäischen Solidarsysteme an die Grenzen ihrer Leistungsfähigkeit bringen können, etwa Sofosbuvir: Die Behandlung der relevanten Patienten mit Sofosbuvir (Basis: kaufkraftbereinigte Preisdaten, Annahme eines Rabatts, Ausgaben für Ribavirin und weitere Behandlungskosten sind dabei nicht berücksichtigt) würde bei den gesamten Arzneimittelausgaben öffentlicher Kostenträger mindestens 10% ausmachen. Dieser Minimalwert träfe auf die Niederlande zu (10,5%), wohingegen in Polen diese Ausgaben 190,5% der gesamten Arzneimittelausgaben betragen würden (12).
Hochpreissegment im europäischen Vergleich: Eine Studie (12) zeigt nicht nur die Grenzen der Finanzierbarkeit neuer Hepatitis-C-Präparate auf, sondern auch die Unterschiede zwischen den Ländern. Für die europäischen Länder liegen nur wenige Preisvergleiche bei den hochpreisigen bzw. kostenintensiven Medikamenten vor; letztere können neben hochpreisigen Arzneispezialitäten auch solche mit hohen Verordnungszahlen umfassen. Die in den vergangenen Jahren veröffentlichten europäischen Preisanalysen von bzw. für Behörden zu ausgewählten umsatzstarken Arzneispezialitäten (13-16) sowie auch wissenschaftliche Fachartikel (17-21) deuten – trotz der Unterschiede in der Methodik – übereinstimmend darauf hin, dass die Schweiz, Deutschland, Schweden und Dänemark zu den hochpreisigen Ländern bei den umsatzstarken, patentgeschützten Arzneimitten zählen. Dies ist nicht verwunderlich, denn diese Länder sind auch wirtschaftlich führend. Eine Analyse nach Kaufkraftparitäten ermöglicht eine differenziertere Beurteilung, allerdings gibt es kaum Arzneimittel-Preisvergleiche zu Kaufkraftparitäten für eine größere Gruppe von Ländern mit unterschiedlicher Wirtschaftskraft (13). In der Analyse von Busse et al. (2016) werden zwar Kaufkraftparitäten verglichen; dabei sind aber auf Grund der Aufgabenstellung nur die AMNOG-relevanten Länder eingeschlossen, die ja über ähnliche Wirtschaftsdaten verfügen (13). Die einzige uns bekannte derartige Studie ist der obenerwähnte internationale Preisvergleich in Hinblick auf Hepatitis-C-Präparate (12). Er ergab bei den in der Studie untersuchten europäischen Ländern höchste (kaufkraftbereinigte) Preise von Sofosbuvir in Polen und der Türkei und niedrigste Preise in Dänemark, Schweden und Norwegen.
In der bereits zitierten Studie von Iyengar et al. (12) aus dem Jahr 2016 wurde ein Lösungsansatz für die bekannten Einschränkungen von Preisvergleichen entwickelt: Es wurde – auf der Basis publizierter Informationen – ein angenommener Rabatt berücksichtigt. Denn einer der Hauptkritikpunkte an Preisstudien ist, dass nur die offiziellen, publizierten Listenpreise verglichen werden, nicht aber die realen (= rabattierten) Preise, die die Kostenträger zu zahlen haben. Dies ist ein richtiger Ansatz, denn gerade bei den hochpreisigen Medikamenten wurden in den letzten Jahren verstärkt Rabattvereinbarungen zwischen den pharmazeutischen Unternehmen und öffentlichen Kostenträgern (in Europa unter dem Oberbegriff „managed entry agreements“ zusammengefasst; 22-28) getroffen. Allerdings sind die Abkommen meist vertraulich und betreffenden Informationen daher nicht zugänglich. Gesetzliche Herstellerrabatte wie in Deutschland sind in Europa eine Seltenheit. Nur vereinzelt wurden Hinweise auf die Höhe der Rabatte publiziert. Onkologinnen und Onkologen verglichen 2015 die Listen- und Echtpreise von neun Krebsmedikamenten in 13 europäischen Ländern. Es zeigten sich deutliche Unterschiede in der Höhe der Rabatte, einerseits zwischen den Krebsmedikamenten und andererseits insbesondere zwischen den Ländern. Spanien und vor allem Italien (Rabatte von mehr als 33 % in einigen Fällen) konnten deutlich höhere Rabatte erzielen als die mittel- und osteuropäischen Länder. In einigen Ländern war entweder das onkologische Medikament gar nicht auf dem Markt, oder es wurde kein Rabatt gegeben (29). Die Ergebnisse sind aufschlussreich, denn seitens der pharmazeutischen Unternehmer wird immer wieder argumentiert, dass mittels vertraulicher Rabatte auch der Zugang zu teuren Medikamenten in ärmeren europäischen Ländern ermöglicht werde (30).
Mythos Forschung und Entwicklungskosten: Seitens der pharmazeutischen Unternehmer werden die hohen Arzneimittelpreise gerechtfertigt mit ihrem therapeutischen Nutzen sowie den hohen, in den vergangenen Jahren gestiegenen Kosten für Forschung und Entwicklung (F+E). Gerade bei den Onkologika zeigen Studienergebnisse, dass der zusätzliche therapeutische Nutzen keineswegs so hoch wie erhofft war und somit die Preise in keinem angemessenen Verhältnis zu ihrem klinischen Nutzen zu stehen scheinen (31).
Hinsichtlich der Höhe der F+E-Kosten für die Entwicklung eines neuen Medikaments liegen unterschiedliche Informationen vor. Bei einer der ersten Publikationen zu diesem Thema bezifferte die forschende pharmazeutische Industrie in den USA die Kosten zur Entwicklung eines Medikaments im Jahr 1987 auf 231 Mio. US$ (32). Spätere Studien mit ähnlicher Methodik bewerteten die Kosten im Jahr 2002 mit 802 Mio. (33) und 2016 mit 2,87 Mrd. US$ (34). Ein Bericht des United Nations Secrectary-General’s High-Level Panel on Access to Medicines zeigte die Bandbreite der Angaben von 100 Mio. bis 4,2 Mrd. US$ auf, wobei in Studien, die von der pharmazeutischen Industrie finanziert werden, tendenziell höhere Werte als in solchen von Non-Profit-Organisationen angeben werden (35). Das von der Industrie häufig angeführte Argument inzwischen aufwändigerer klinischer Studien mag berechtigt sein; es sollte allerdings im Detail gemeinsam mit anderen Parametern (z.B. der Zahl der in klinischen Studien untersuchten Patienten, beschleunigten Zulassungsverfahren), welche die F+E-Kosten beeinflussen, überprüft werden. Bei dem Versuch, mehr Transparenz und Plausibilität von F+E-Kosten zu erhalten, ist schließlich auch zu berücksichtigen, dass in die Entwicklung neuer Arzneimittel oft erhebliche öffentliche Mittel investiert werden, z.B. in Form der Finanzierung universitärer Grundlagenforschung. Bei wissenschaftlichem Erfolg kann dies dazu führen, dass multinationale Konzerne Start-up-Unternehmen aufkaufen. Vielzitiertes Beispiel in diesem Zusammenhang ist wiederum Sofosbuvir, für dessen Vermarktungsrechte Gilead 11 Mrd. US$ zahlte – einen Beitrag, den das Unternehmen bereits im ersten Jahr wieder einspielte (36).
Suche nach Lösungen: Es ist ethisch zu fordern, dass der Zugang zu neuen, wirksamen Medikamenten für Patientinnen und Patienten gewährleistet sein muss; allerdings müssen die Kosten ebenfalls ethisch und ökonomisch vertretbar sein. Eine Reihe verschiedener Lösungsansätze wird diskutiert. Sie unterscheiden sich hinsichtlich ihrer Realisierbarkeit und ihrer zeitlichen Umsetzbarkeit.
Tiefgreifende Veränderungen würden neue „Business-Modelle“ erfordern, bei denen die Entwicklung neuer Medikamente nicht von der Gewinnorientierung multinationaler Unternehmen getrieben wird. Die Umsetzung dieser Ansätze, die oft auch unter dem Schlagwort „Entkoppelung der Medikamentenpreise von Forschungs- und Entwicklungskosten“ diskutiert werden, würden Änderungen bestehender Strukturen erfordern: Änderung des Patentrechts, neue Anreizstrukturen und Finanzierungsmodelle inkl. verstärkter staatlicher Investitionen in unabhängige Arzneimittelforschung im Non-Profit-Bereich (Universitäten, Nichtregierungsorganisationen) sowie neue Formen der Zusammenarbeit zwischen Forschung, Ärztinnen/Ärzten und der staatlichen Hand. Modellprojekte in diesem Zusammenhang waren bislang vor allem auf den globalen Süden mit mangelndem Zugang zu Medikamenten ausgerichtet. Angesichts des Drucks, den teure Medikamente auf wirtschaftlich starke Länder ausüben, werden diese Ideen nun auch in Europa diskutiert. Die EU-Ratspräsidentschaft der Niederlande im ersten Halbjahr 2016 machte auf die oben geschilderten Probleme aufmerksam (37) und suchte gemeinsam mit europäischen Partnern nach Lösungen. So wird in den Schlussfolgerungen des EU-Rates zur Verstärkung der Ausgewogenheit der Arzneimittelsysteme in der EU und ihren Mitgliedstaaten (38) die Forderung nach einer faktenbasierten Analyse der Auswirkungen der Anreize der EU-Rechtsakte erhoben, insbesondere in Bezug auf patentrechtliche Regelungen, auf Innovation und Verfügbarkeit.
In den vergangenen Jahrzehnten wurden vermehrt länderübergreifende Kooperationen zwischen Behörden ins Leben gerufen, die für Arzneimittelpreise und -erstattung zuständig sind. Derzeit dienen diese Netzwerke hauptsächlich dem Erfahrungsaustausch und der Weitergabe von Wissen. Die Ausweitung in Richtung gemeinsamer Verhandlungen und gemeinsamen Einkaufs werden als ein Weg für die Zukunft gesehen, denn diese Kooperationen stärken die Verhandlungsposition der Einkäufer. Auch die pharmazeutische Industrie räumt ein, dass öffentliche Kostenträger ihre Verhandlungsmacht nicht voll nutzen (39). Einige Länder haben diesbezügliche Kooperationen gestartet. Die wahrscheinlich bekannteste Initiative ist BeNeLuxA, ein Zusammenschluss von Belgien, den Niederlanden, Luxemburg und Österreich, Ländern, die neben gemeinsamen Verhandlungen auf gemeinsames Horizon-Scanning (Beobachtung der Pipeline, um rechtzeitig auf neue Arzneispezialitäten vorbereitet zu sein) und gemeinsames Health-Technology-Assessment (HTA) setzen (40). Daneben bestehen Kooperationen zwischen anderen Ländern, wie etwa die Nordic Cooperation unter den skandinavischen Ländern (41) und der Zusammenschluss osteuropäischer Länder („Visegrád“-Gruppe) bzw. sind im Aufbau (42). Diese Aktivitäten ergänzen Initiativen auf europäischer Ebene wie etwa die Zusammenarbeit im HTA-Bereich im Rahmen von EUnetHTA, bei der auch über die zukünftige Ausrichtung diskutiert wird (43).
Solche Kooperationen sind eine Chance zum Austausch von Wissen und Erfahrung zwischen Staaten; daneben wird aber auch die Forderung nach mehr Transparenz laut. Dies betrifft insbesondere Transparenz hinsichtlich der tatsächlichen Kosten, die bei der F+E eines neuen Medikaments anfallen, und der „echten“ Preise von Arzneimitteln, die von den öffentlichen Kostenträgern zu zahlen sind. Letzteres ist insofern wichtig, als die meisten europäischen Länder bei der Festsetzung der Preise in einem ersten Schritt auf Preisdaten in anderen Ländern zurückgreifen (Politik des „external price referencing“; 44), aber in Unkenntnis der tatsächlich ausgehandelten Preise von den höheren offiziellen Listenpreisen ausgehen müssen.
Vision „Faire Arzneimittelpreise“: Es liegen Konzepte für faire Arzneimittelpreise auf dem Tisch, d.h. solche, die eine Versorgung der Bevölkerung mit sicheren und hochwertigen Medikamenten gewährleisten (45). Viele von ihnen werden bereits seit Jahren diskutiert, zunächst jedoch im Kontext der Medikamentenversorgung für arme Länder des globalen Südens (46). Der Ernst der ökonomischen Situation – mittlerweile auch in wirtschaftsstarken europäischen Ländern – und die Dringlichkeit von Änderungen scheint den Entscheidungsträgern bewusst.
Literatur
- AMB 2015,49, 16DB01. Link zur Quelle
- Gonçalves,A., et al.: Ann. Oncol. 2016, 27, 1812. Link zur Quelle
- Expertsin Chronic Myeloid Leukemia: Blood 2013, 121, 4439. Link zur Quelle
- Kanavos,P., und Nicod, E.: Value Health 2012, 15, 1182. Link zur Quelle
- World Health OrganizationRegional Office for Europe. Access to new medicines in Europe: technical reviewof policy initiatives and opportunities for collaboration and research. Copenhagen, 2015. Link zur Quelle
- AMB2016, 50, 01 Link zur Quelle . AMB 2015, 49, 40DB01 Link zur Quelle. AMB 2013, 47, 33. Link zur Quelle
- AMB2016, 50, 62. Link zur Quelle
- OECD.Health Data. Paris: OECD; 2017. Link zur Quelle
- WHO.Health in 2015: from MDGs to SDGs. 2015. Link zur Quelle
- Civan, A., und Köksal, B.: HealthEcon. 2010, 19, 581. Link zur Quelle
- Schwabe, U., und Paffrath, D. (Hrsg.):Arzneiverordnungs-Report 2016. Springer-Verlag, Berlin Heidelberg 2016.
- Iyengar, S., et al.: PLoS Med. 2016, 13, e1002032. Link zur Quelle
- Busse, R., et al. in: Schwabe, U., und Paffrath, D.(Hrsg.): Arzneiverordnungs-Report 2016. Springer-Verlag, Berlin Heidelberg2016. S. 193.
- Aho, E., et al.:International price comparison of pharmaceuticals 2016 – a volume basedanalysis of Swedish pharmaceutical prices relative to 19 other Europeancountries. TLV. Stockholm, 2017.
- Vogler, S., et al.: Preisvergleichkostenintensiver Arzneimittel 2015. Wien: Gesundheit Österreich GmbH, 2016. Link zur Quelle
- santésuisse. Auslandspreisvergleich2016: Patentschützte Medikamente Solothurn: santesuisse, 2017. Link zur Quelle
- Kanavos, P., und Vandoros, S.:Health Econ. Policy Law 2011, 6, 337. Link zur Quelle
- Vogler, S., et al.: Lancet Oncology2016, 17, 39. Link zur Quelle
- Vogler, S., et al.: ValueHealth 2015, 18, 484. Link zur Quelle
- Young, K.E., et al.: J. Mark. Access Health Policy2017, 5, 1297886. Link zur Quelle
- AMB 2016, 50, 01 Link zur Quelle
- Vogler, S., et al.: SouthMed. Rev. 2012, 5, 38. Link zur Quelle
- Morgan, S.G., et al.:Health Policy 2017, 121, 354. Link zur Quelle
- Ferrario, A., undKanavos, P.: Managed entry agreements for pharmaceuticals: The Europeanexperience: LSE; 2013. Link zur Quelle
- Ferrario, A., und Kanavos, P.: Soc. Sci. Med. 2015, 124,39. Link zur Quelle
- Garrison, L.P., et al.: Value Health 2013, 16,703. Link zur Quelle
- Adamski, J., et al.: BMCHealth Serv. Res. 2010, 10, 153. Link zur Quelle
- Pauwels, K., et al.: Front. Pharmacol. 2017, 8,171. Link zur Quelle
- van Harten, W.H., et al.: LancetOncol. 2016, 17, 18. Link zur Quelle
- Towse, A., et al.:International Journal of the Economics of Business 2015, 22, 263. Link zur Quelle
- Mailankody, S., undPrasad, V.: JAMA Oncol. 2015, 4, 539. Link zur Quelle.Vgl. AMB 2015, 49, 40DB01. Link zur Quelle
- DiMasi, J.A., et al.: J. HealthEcon. 1991, 10, 107. Link zur Quelle
- DiMasi, J.A., et al.: J. HealthEcon. 2003, 22, 151. Link zur Quelle
- DiMasi, J.A., et al.: J. HealthEcon. 2016, 47, 20. Link zur Quelle
- Report of the UnitedNation Secretary-General’s high-level panel on access to medicines: Promotinginnovation and access to health technologies. New York, 2016. Link zur Quelle
- Roy, V., und King, L.: BMJ 2016, 354,i3718 Link zur Quelle. Vgl. AMB 2015,49, 16DB01. Link zur Quelle
- Dutch Ministry of HealthWelfare and Sport. Summary of Medicines Plan. 2016. Link zur Quelle
- Rat der EuropäischenUnion. Schlussfolgerungen des Rates zur Verstärkung der Ausgewogenheit derArzneimittelsysteme in der EU und ihren Mitgliedstaaten. 2016. Link zur Quelle
- Vogler, S., et al.: J. Pharm. Policy Pract.2016, 9, 9. Link zur Quelle
- Henrarda, S. und Arickx, F.: Bull. World Health Organ. 2016,94, 779. Link zur Quelle
- Könberg, B.: The FutureNordic Co-operation on Health. Secretariat NCoM. Copenhagen, 2014. Link zur Quelle
- Espin, J., et al.: Howcan voluntary cross-border collaboration in public procurement improve accessto health technologies in Europe? European Observatory on Health Systems andPolicies. Kopenhagen, 2016. Link zur Quelle
- Europäische Kommission -Generaldirektion Gesundheit und Lebensmittelsicherheit. Strengthening of the EUcooperation on Health Technology Assessment (HTA) – Online public consultationreport. 2017. Link zur Quelle
- Vogler, S., et al.: Studyon enhanced cross-country coordination in the area of pharmaceutical productpricing. European Commission, Directorate-General for Health and Food SafetyEd.; Brussels: Publications Office of the European Union 2016. Link zur Quelle
- Wirtz, V.J., et al.: Lancet 2016, 389,403. Link zur Quelle
- Trouiller, P., et al.:Lancet 2002, 359, 2188. Link zur Quelle