Zusammenfassung: Die größte bisher durchgeführte Metaanalyse zur Behandlung mit Antidepressiva kommt zu dem Schluss, dass Antidepressiva bei mittelschweren und schweren Episoden einer unipolaren Depression durchweg wirksamer sind als Plazebo. Die Akzeptanz der Therapie – gemessen an der Abbruchrate („dropout rate“) – variiert sehr stark zwischen den einzelnen Wirkstoffen, liegt aber im Mittel im Bereich von Plazebo. Die Effektstärke ist moderat, und es sind keine speziellen Klasseneffekte bei den Wirkstoffen erkennbar, was Zweifel an den behaupteten Wirkmechanismen weckt. Einige Antidepressiva scheinen in der Erstlinientherapie günstiger zu sein als andere. Die Beweiskraft dieser Aussagen wird u.a. dadurch eingeschränkt, dass 91% der untersuchten 522 Studien ein mittleres oder hohes Risiko für Verzerrung der Ergebnisse (Bias) haben. Zudem darf diese grundsätzlich positive Einschätzung nicht auf mildere Formen, eine längere Behandlung (> 8 Wochen), auf eine Zweitlinientherapie bei Non-Respondern, auf Kinder und Jugendliche und andere Formen von Depressionen übertragen werden.
„Das Verordnungsvolumen von Antidepressiva (AD) ist nicht nur in Deutschland, sondern in vielen Ländern, incl. USA, irritierend hoch“ – das schreiben die Autoren des Kapitels „Psychopharmaka“ im Arzneiverordnungs-Report 2017. 2016 wurden in Deutschland 1,46 Mrd. Tagesdosen AD verordnet. Das entspricht einer Zunahme um 67% in den letzten 10 Jahren. Eine rational begründete Indikation wird bezweifelt (1), eine Überversorgung ist sehr wahrscheinlich. Ein wichtiger Grund für die häufige und weiter steigende Verordnung von AD dürfte sein, dass deren Nutzen überschätzt und die Behandlungsrisiken unterschätzt werden (vgl. 10, 11).
Bei der medikamentösen Behandlung von Depressionen gibt es ausgeprägte Plazeboeffekte (2, 13). Während bei leichten Depressionen (≤ 15 Punkte auf der Hamilton-D17-Skala; vgl. 10) Plazebos oder Pseudoplazebos (niedrige und weitgehend wirkungslose Dosis eines Wirkstoffs) etwa gleich wirksam sind wie AD, sind diese bei mittelschweren bis schweren Depressionen wirksamer als Plazebo (3). Bei den schweren Formen der Depression profitieren bis zu 30% der Patienten über den Plazeboeffekt hinaus von der Einnahme eines AD (3). Daher soll nach der Nationalen VersorgungsLeitlinie (NVL) „Unipolare Depression“ Patienten mit akuter mittelschwerer depressiver Episode eine medikamentöse Therapie angeboten werden (Empfehlungsgrad A). Außerdem soll bei akuten schweren depressiven Episoden eine Kombinationsbehandlung mit AD und Psychotherapie durchgeführt werden (Empfehlungsgrad A).
Weniger klar ist, welches AD verwendet werden soll. Die NVL empfiehlt als Auswahlkriterien heranzuziehen: Verträglichkeit, Sicherheit im Falle von Überdosierung, Ansprechen in einer früheren Krankheitsepisode, Handhabbarkeit, Anwendungserfahrung, Möglichkeiten bei Nichtansprechen, Komorbiditäten, Komedikation sowie Patientenpräferenzen (3, vgl. 10). Weltweit sind > 40 verschiedene AD zugelassen; Marktführer in Deutschland waren 2016 Citalopram (290 Mio. Tagesdosen), Venlafaxin (189 Mio Tagesdosen) und Mirtazapin (180 Mio. Tagesdosen; 1). Die Auswahl des Präparats erfolgt nicht selten nach lokalen Gepflogenheiten und dem Geschick des Marketings.
Im Februar wurde im Lancet die größte Metaanalyse veröffentlicht, die jemals zur Therapie von Depressionen mit AD durchgeführt wurde (4). Sie fand sofort ein sehr breites Echo in den Laienmedien („Antidepressiva effektiver als Placebo“; 5). Eine Gruppe aus Oxford, Kyoto, Bern, Paris, München, Portland, Bristol und Stanford hat eine Netzwerk-Metaanalyse durchgeführt, in der 21 verschiedene AD indirekt und direkt miteinander verglichen wurden. Diese Mammutaufgabe wurde mit öffentlichen Geldern aus Großbritannien und Japan finanziert (Grants vom National Institute for Health Research, dem Oxford Health Biomedical Research Centre und der Japan Society for the Promotion of Science). Nur 4 der 18 Autoren geben Interessenkonflikte mit der Pharmaindustrie an.
Eingeschlossen wurden nur doppelblinde, randomisierte, kontrollierte Studien (RCT), in denen ein orales AD zur akuten Erstlinien-Therapie einer unipolaren mittelschweren oder schwereren depressiven Episode bei Erwachsenen getestet und mit Plazebo oder einem zweiten AD verglichen wurde. Es wurden nur AD einbezogen, die in den USA, Europa und/oder Japan zugelassen sind und in üblichen Dosen verwendet wurden (s. Tab. 1). Ausgeschlossen waren u.a. Studien mit unzureichender Randomisierung, nicht vollständig zu erhebenden Daten, einem größeren Anteil von Patienten mit bipolarer Störung oder mit einer behandlungsresistenten Depression. Studien zur Wirksamkeit und dem Stellenwert von Lithium (vgl. 16) oder Johanniskraut (17) wurden nicht einbezogen.
Nach den Studien wurde in den üblichen Datenbanken (Pubmed, Embase etc.) gesucht, sowie in Studienregistern (z.B. ClinicalTrials.gov), den Webseiten der Zulassungsbehörden (FDA, EMA) sowie der pharmazeutischen Unternehmer (pU). Es wurde also auch systematisch nach nicht-publizierten Studienergebnissen gefahndet. Bei fehlenden Daten wurden die Studienverantwortlichen kontaktiert und um Zusendung der Daten gebeten. Sechs Autorenpaare wählten dann die in Frage kommenden Studien unabhängig voneinander aus. Von den mehr als 28.500 Treffern nach der Primärsuche kamen 680 Studien in die engere Auswahl und wurden im Volltext gelesen. Infolge von Doppelpublikationen und aufgrund anderer Ausschlusskriterien verblieben 522 Studien für die Metaanalyse; von diesen war fast jede Fünfte (n = 101) nicht publiziert.
Aus diesen Studien wurden nun alle relevanten Informationen für die Vergleichsberechnungen entnommen. Die Extraktionstabelle wird allen Lesern barrierefrei auf Mendely© zur Verfügung gestellt (6). Neben den primären Analysen der Daten wurden auch das Risiko für einen Bias nach dem Cochrane Handbuch (7) und die Sicherheit der Evidenz an Hand der GRADE-Kriterien (Grading of Recommendations Assessment, Development and Evaluation) bewertet (8).
Primäre Endpunkte waren die Wirksamkeit der Behandlung nach 8 Wochen („Effektivität“, Definition: Anteil der Patienten mit einer Symptomreduktion um ≥ 50%, gemessen mit einer standardisierten Depressionsskala) und die „Akzeptanz“ der Behandlung (Definition: Therapie-Abbruchrate, unabhängig von den Gründen; vgl. auch 12).
Ergebnisse: In den 522 Studien aus den Jahren 1979-2016 wurden insgesamt 116.477 Patienten untersucht. Von pU wurden 78% der Studien (n = 409) gesponsert; bei den übrigen war die Finanzierung oft unklar. Bei mehr als der Hälfte der Studien (n = 274) mussten für die Metaanalyse nicht-publizierte Ergebnisse beschafft werden.
Die mittlere Teilnehmerzahl pro Studie betrug 224 ± 186 (Spanne: 7-1019). Mit einem AD wurden 87.052 Patienten behandelt und 29.425 erhielten ein Plazebo. Das mittlere Alter der Patienten betrug 44 ± 9 Jahre, und 62,3% waren Frauen. Der Ausgangswert auf der Hamilton-D17-Skala betrug im Mittel 25,7 ± 3,9 (die Skala reicht von 0-51; bei Werten ≥ 25 gilt eine Depression als „schwer“; vgl. 10).
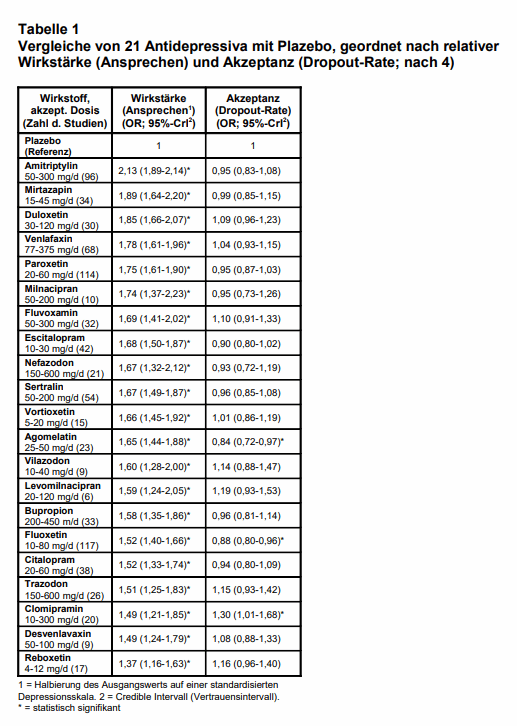
Die Ergebnisse der Effektivitäts- und Akzeptanzberechnungen im Vergleich mit Plazebo sind in Tab. 1 wiedergegeben. Im Hinblick auf die Effektivität (Wirkstärke) waren alle getesteten AD der Behandlung mit Plazebo überlegen mit einer Odds ratio (OR) von 2,13 (Amitriptylin; in Übereinstimmung mit 20, 21) bis 1,37 (Reboxetin). Die Autoren sprechen allerdings von bescheidenen Effektgrößen. Die Therapie-Akzeptanz bei den AD – auch hier verglichen mit Plazebo – war sehr unterschiedlich: von OR 0,84 (Agomelatin; höchste Akzeptanz) bis OR 1,30 (Clomipramin; niedrigste Akzeptanz), im Mittel lag sie im Bereich von Plazebo.
Es gab eine Vielzahl von Subanalysen, deren Ergebnisse hier stichpunktartig zusammengefasst sind:
-
In den Studien mit direkten Head-to-Head-Vergleichen waren die Unterschiede der Effektivität zwischen den einzelnen AD etwas größer als in den indirekten Vergleichen über Plazebo (OR: 1,06-1,98; Referenzsubstanz war Reboxetin), was nochmals Hinweise auf die große Bedeutung des Plazeboeffekts gibt.
-
Agomelatin, Amitriptylin, Escitalopram, Mirtazapin, Paroxetin, Venlafaxin und Vortioxetin (s. dazu kritische Bewertung weiter unten) waren nach den Head-to-Head-Studien die effektivsten AD (OR: 1,19-1,96) und Fluoxetin, Fluvoxamin, Reboxetin und Trazodon die am wenigsten wirksamen (OR: 0,51-0,84).
-
Ein Gruppeneffekt war bei den verschiedenen Wirkstoffklassen (selektive Serotonin-Wiederaufnahme-Hemmer, selektive Serotonin-Noradrenalin-Wiederaufnahmehemmer, nichtselektive Monoamin-Wiederaufnahmehemmer u.a.) nicht erkennbar, was Zweifel an dem jeweils vermuteten Wirkprinzip aufwirft.
-
Die Dropout-Rate wegen Nebenwirkungen war bei allen AD (bis auf Agomelatin) höher als bei Plazebo (OR: 1,64-4,44). Amitriptylin, Clomipramin, Duloxetin, Fluvoxamin, Reboxetin, Trazodon und Venlafaxin hatten die höchsten Dropout-Raten.
-
Bei AD, die zum Zeitpunkt der Studiendurchführung neu waren, fanden sich größere Therapieeffekte als bei etablierten AD („novelty effect“).
-
Ältere Studien und RCT mit kleinen Patientenzahlen zeigen eine größere Effektivität der AD gegenüber Plazebo als Studien jüngeren Datums oder mit großen Teilnehmerzahlen (gilt besonders für Amitriptylin, Bupropion, Fluoxetin und Reboxetin).
-
Eine Studienfinanzierung durch pU war nicht mit besseren Ergebnissen hinsichtlich der Effektivität und Akzeptanz assoziiert. Die Aussagekraft dieser Subanalyse ist allerdings aufgrund der geringen Zahl unabhängiger Studien stark einschränkt.
Das Risiko für einen relevanten Bias wurde bei 46 Studien (9%) als hoch, bei 380 (73%) als moderat und bei 96 (18%) als gering eingeschätzt. Hauptkritikpunkte waren Unklarheiten bei der Randomisierung und der Gruppenzuteilung, eine unsichere Verblindung der Nachuntersucher, ein Abweichen vom Protokoll sowie ein häufiges vorzeitiges Ausscheiden aus der Studie (attrition bias). Die GRADE-Bewertung für die Beweiskraft fiel entsprechend bei den meisten Studien nur mittelmäßig und bei den Studien mit Vortioxetin, Nefazadon, Clomipramin, Bupropion und Amitriptylin sogar besonders schlecht aus.
Die Schlussfolgerung, dass AD bei schweren Episoden einer unipolaren Depression bei gleicher Therapieakzeptanz durchweg wirksamer sind als Plazebo, wird von den Autoren dahingehend eingeschränkt, dass sich viele nachteilige Wirkungen der AD erst nach einer längeren Behandlung als 8 Wochen zeigen. Die scheinbar positive Nutzen-Risiko-Relation könnte sich also nach mehreren Monaten Therapie als weniger günstig darstellen. Daher seien auch Metaanalysen für die Langzeitanwendung von AD erforderlich, zumal diese ja sehr häufig über viele Monate und Jahre verordnet werden. Als weitere wichtige Einschränkung wird die Beschränkung auf die Mono- und Erstlinientherapie genannt.
Schliesslich kreist die Diskussion um das der AD-Therapie zu Grunde liegende pharmakologische Konzept. Die Ergebnisse bei Erwachsenen unterscheiden sich nach Angaben der Autor(inn)en grundsätzlich von denen bei Kindern und Jugendlichen. Bei diesen wird eine Pharmakotherapie wegen unklarer Nutzen-Risiko-Relation überhaupt erst ab einem Alter von 8 Jahren empfohlen – zuvor kognitiv-verhaltenstherapeutische oder eine interpersonelle Psychotherapie (vgl. 18). Hiernach wird Fluoxetin als Mittel der Wahl genannt, da nur für dieses ausreichend Evidenz gesehen wurde, depressive Symptome zu lindern. Zum gleichen Ergebnis kam auch eine Metaanalyse aus dem Jahre 2016 (19) von der Erstautorin dieser Metaanalyse (4). Die heterogene Wirksamkeit von AD bei verschiedenen Altersgruppen könnte auf unterschiedliche Mechanismen und Ursachen von Depressionen hinweisen oder auf bedeutsame methodische Probleme bei Erwachsenen- und pädiatrischen Studien (z.B. Unterschiede beim Ausmaß des Plazeboeffekts). Ein großes methodologisches Problem in diesem Zusammenhang ist auch, dass in den allermeisten Studien keine aktiven Plazebos verwendet wurden, also solche mit spürbaren Wirkungen wie Mundtrockenheit. Durch die Verwendung inaktiver Plazebos ist die Verblindung der Patienten gefährdet und es besteht ein hohes Risiko, dass das Ergebnis zu Gunsten der Antidepressiva verzerrt wird. Auch die mögliche Bedeutung der nicht medikamentösen Begleittherapie auf die Studienergebnisse sei an dieser Stelle der Vollständigkeit halber noch erwähnt. Gerade bei indirekten Vergleichen über einzelne Studien hinweg kann dieser Störfaktor das Ergebnis bedeutsam verzerren.
Zwei klinische Psychiater aus Ann Arbor und Toronto kommentieren die Metaanalyse und lehnen sich nach unserer Einschätzung sehr weit aus dem Fenster (9). Sie nennen drei AD, die auf Grund ihrer günstigen Nutzen-Risiko-Relation als Mittel der ersten Wahl bei schwerer Depression verwendet werden sollten (Agomelatin, Escitalopram und Vortioxetin) und raten zugleich Fluvoxamin, Reboxetin und Trazodon in der Initialtherapie zu vermeiden. Die Empfehlung von Vortioxetin muss allerdings sehr kritisch gesehen werden angesichts der Beurteilung des Gemeinsamen Bundesausschusses und seiner Begründung „ein Zusatznutzen ist nicht belegt“ (14) sowie einer anderen ausführlichen Darstellung und Auswertung der Studien zu diesem AD (15). Der Schweregrad einer Depression oder andere Patientenmerkmale könnten allerdings auch zu einer anderen Medikamenten-Auswahl führen (z.B. Amitriptylin bei besonders schwerer Depression). Auch sei der bekannte Aspekt des sehr heterogenen interindividuellen Ansprechens auf einzelne AD nicht ausreichend berücksichtigt worden. Es gäbe gewisse Merkmale (klinische oder neurophysiologische Phänotypen), die ein Ansprechen auf ein bestimmtes AD möglicherweise voraussagen könnten, was in der Zukunft bei der Auswahl eines AD hilfreich sein könnte.
Literatur
- Lohse, M.J., und Müller-Oerlinghausen, B.: Psychopharmaka. In: Arzneiverordnungs-Report 2017. Schwabe, U., Paffrath, D., Ludwig, W.-D., Klauber, J. (Hrsg.). Springer-Verlag, 2017; S. 681.
- AMB 2017, 51, 25. Link zur Quelle
- Nationale VersorgungsLeitlinie. Unipolare Depression. Kurzfassung 2. Auflage, 2017. Link zur Quelle Zugriff am 28.2.2018.
- Cipriani, A., et al.: Lancet 2018 Feb 20. Link zur Quelle
- https://www.derstandard.de/… Link zur Quelle Zugriff am 28.2.2018
- DOI:10.17632/83rthbp8ys.2. Zugriff am 28.2.2018.
- http://handbook-5-1.cochrane.org/. Link zur QuelleZugriff am 28.2.2018.
- Salanti, G., et al.: PLoS One 2014, 9, e99682. Link zur Quelle
- Parikh, S.V., und Kennedy, S.H.: Lancet 2018 F eb 20. Link zur Quelle
- AMB 2010, 44, 33. Link zur Quelle
- AMB 2015, 49, 48DB01. Link zur Quelle
- AMB 2017, 51, 70. Link zur Quelle
- Locher, C., et al.: JAMA Psychiatry 2017, 74, 1011. Link zur Quelle
- https://www.g-ba.de/… Link zur Quelle
- Cosgrove, L., et al.: Account. Res. 2016, 23, 257. Link zur Quelle
- AMB 2003, 37, 49. Link zur Quelle
- AMB 2008, 42, 86a. Link zur Quelle
- http://www.awmf.org/… Link zur Quelle
- Cipriani, A., et al.: Lancet 2016, 388, 881. Link zur Quelle
- Anderson, I.M.: J. Affect. Disord. 2000, 58, 19. Link zur Quelle
- Arroll, B., et al.: Ann. Fam. Med. 2005, 3, 449. Link zur Quelle